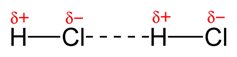#كفايات_كيمياء
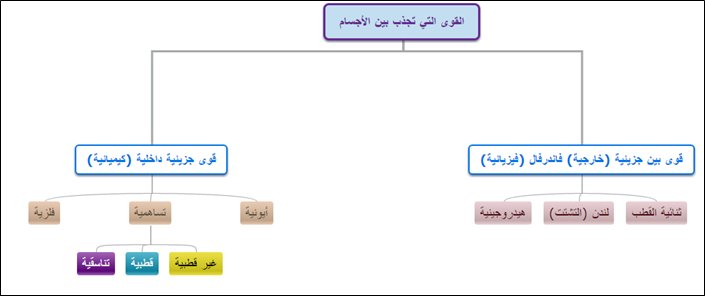
قوى الجذب بين الجسيمات
قوى الجذب بين الجسيمات
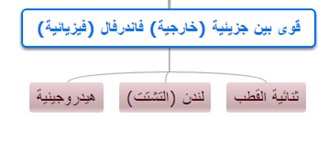
القوى الفيزيائية (فاندرفالز)
1-بين جزيئات المادة
2- ضعيف وتكسر بطرق فيزيائية (كالتبخير) دون المساس بخواصها الكيميائية
#كفايات_كيمياء
1-بين جزيئات المادة
2- ضعيف وتكسر بطرق فيزيائية (كالتبخير) دون المساس بخواصها الكيميائية
#كفايات_كيمياء
الرابطة الهيدروجينية أقوى الروابط الفيزيائية لذا ترتفع درجتي الغليان والانصهار + أنها سبب لذوبان الكثير من المواد في الماء
#كفايات_كيمياء
#كفايات_كيمياء
القوى الهيدروجينية وثنائية القطب تحدث بين جزيئات الحالة السائلة والصلبة لذا هي دائمة مالم يتم كسرها بأي طرق فصل فيزيائية
#كفايات_كيمياء
#كفايات_كيمياء
#كفايات_كيمياء
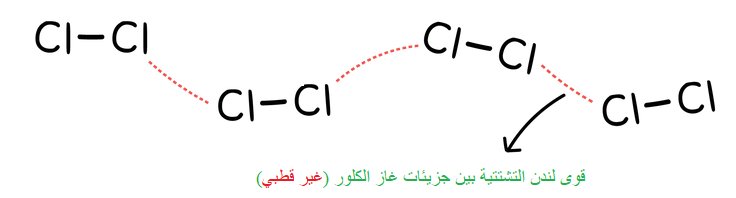
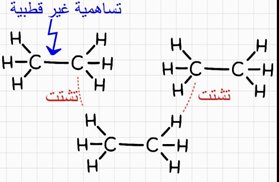
3- قوى لندن التشتتية تحدث بين الجزيئات في جميع الحالات(صلبة, سائلة, غازية) قطبية و غير قطبية
تكون أقوى كلما كبر حجم الجزيء
3- قوى لندن التشتتية تحدث بين الجزيئات في جميع الحالات(صلبة, سائلة, غازية) قطبية و غير قطبية
تكون أقوى كلما كبر حجم الجزيء
قوى لندن هي القوى الوحيدة التي تنشأ بين جسيمات الغازات غير القطبية مثل O2 , N2 , F2 , الغازات الخاملة , الألكانات الغازية
#كفايات_كيمياء
#كفايات_كيمياء
حجم الذرة تزداد نزولا في المجموعة
وقوى لندن تكون أقوى مع زيادة الحجم
لذا قوى لندن بين جزيئات اليود أقوى من التي بين جزيئات البروم وهكذا
وقوى لندن تكون أقوى مع زيادة الحجم
لذا قوى لندن بين جزيئات اليود أقوى من التي بين جزيئات البروم وهكذا
لذا جزيء اليود صلب , البروم سائل , الكلور والفلور غازات لأن قوى لندن فيها أضعف
#كفايات_كيمياء
#كفايات_كيمياء
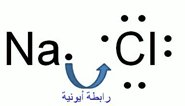
الرابطة الأيونية : تنشأ عن انتقال إلكترون من الفلز إلى اللافلز فيحدث بينهما تجاذب
وهو أقوى أنواع الروابط الكيميائية
#كفايات_كيمياء
وهو أقوى أنواع الروابط الكيميائية
#كفايات_كيمياء
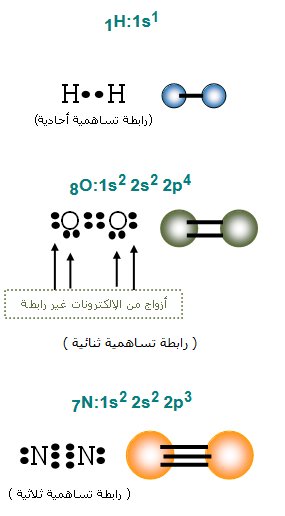
الرابطة التساهمية : تنشأ بين ذرتين لافلزيتين عن طريق التشارك بين بزوج أو أكثر من الإلكترونات.
#كفايات_كيمياء
#كفايات_كيمياء
تكون الروابط التساهمية أحادية (سيجما) أو ثنائية(سيجما, باي) أو ثلاثية(1 سيجما , 2 باي) على حسب عدد الأزواج الالكترونية الداخلة في الرابطة
الرابطة التساهمية غير القطبية تنشأ عن ذرات من نفس النوع مثل غازات N2 , O2 , F2 أو نوع مختلف مثل الرابطة C-H في الهيدروكربونات
#كفايات_كيمياء
#كفايات_كيمياء
أما الروابط التساهمية القطبية تنشأ بين ذرتين بينهما فرق كبير في الكهروسالبية مثل
O-H , C-O , N-H , C-F ..
#كفايات_كيمياء
O-H , C-O , N-H , C-F ..
#كفايات_كيمياء
لهنا يتبين أن الروابط التساهمية تنشأ من تشارك متساوٍ, يعني إذا الذرة 1شارك بالإلكترون الذرة 2 تشارك بإلكترون , ذيك شاركت ب3 الثانية زيها ..
فيه نوع خاص من الروابط التساهمية التشارك فيه غير متساوي هي الروابط التناسقية
ذرة تشارك بإلكترونات حرة(غير رابطة) والثانية تساهم بمدار فارغ
ذرة تشارك بإلكترونات حرة(غير رابطة) والثانية تساهم بمدار فارغ
الروابط الفلزية
من زمان يقولون لنا أن الفلزات موصلة جيدة للكهرباء بسبب وجود إلكترونات حرة الحركة على سطحها .. إيش قصة هالإلكترونات
من زمان يقولون لنا أن الفلزات موصلة جيدة للكهرباء بسبب وجود إلكترونات حرة الحركة على سطحها .. إيش قصة هالإلكترونات
كذا صارت الذرات مشحونة (موجبة) . لكن يظل بينها وبين الإلكترونات الحرة قوى جذب تنشأ عنها الرابطة الفلزية
#كفايات_كيمياء
#كفايات_كيمياء
رابط يوضح أنواع الروابط الكيميائية + وخصائص المواد الناتجة عنها بشكل سلس وواضح
#كفايات_كيمياء
schoolarabia.net
#كفايات_كيمياء
schoolarabia.net
#كفايات_كيمياء
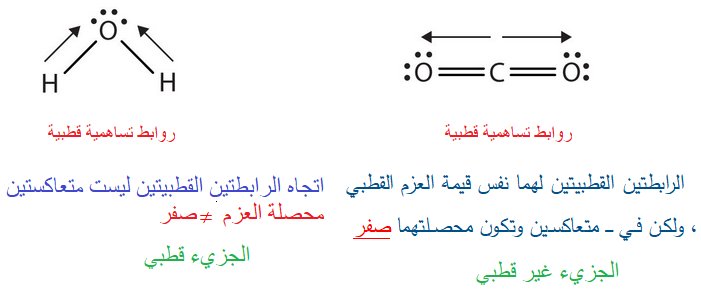
معلومة : ليس بالضرورة ان اي جزيء به ذرات متفاوته في الكهروسالبية نقول عنه قطبي
@K2CrO:
معلومة : ليس بالضرورة ان اي جزيء به ذرات متفاوته في الكهروسالبية نقول عنه قطبي
@K2CrO:
قطبية الرابطة تعتمد على عوامل وهي:
اختلاف الذرتين المكونتين للرابطة .
فالجزيئات المتماثلة F2 غير قطبية بينما HF
#كفايات_كيمياء
اختلاف الذرتين المكونتين للرابطة .
فالجزيئات المتماثلة F2 غير قطبية بينما HF
#كفايات_كيمياء
#كفايات_كيمياء
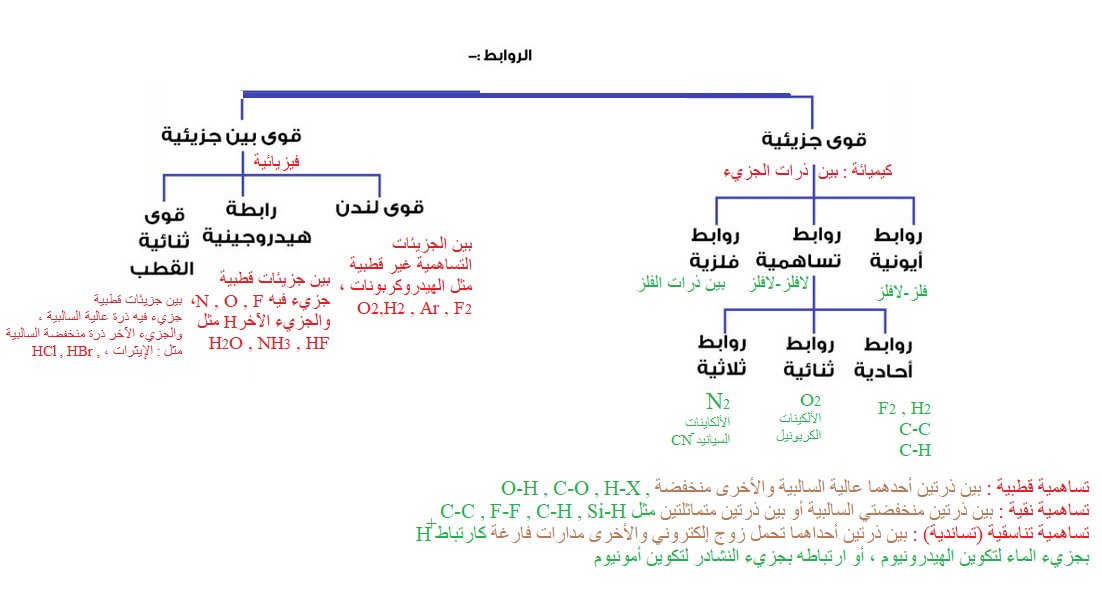
ملخص للروابط
فرقوا بين كلمة (بين جزيئية أو بين جزيئات ...... )
وبين كلمة في جزيئات ........
ملخص للروابط
فرقوا بين كلمة (بين جزيئية أو بين جزيئات ...... )
وبين كلمة في جزيئات ........
جاري تحميل الاقتراحات...