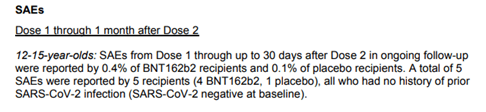كيف تلاعبت Pfizer بالبروتوكولات التجريبية للقاح COVID للحصول على تصريح طارئ من إدارة الغذاء والدواء للأطفال
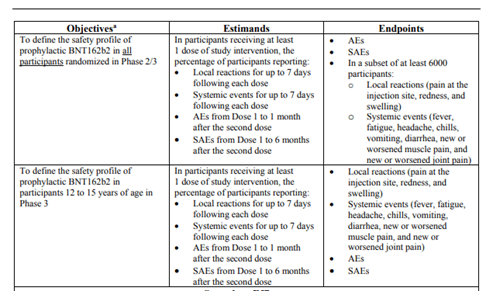
عند تحليل ومقارنة وثيقة المراجعة التي قدمتها Pfizer إلى FDA التي على أساسها أعطيت ضوء أخضر لتوسيع تصريح الطوارئ أيضا للأطفال الذين تتراوح أعمارهم بين 12-15 (الفقرة1)
1.
عند تحليل ومقارنة وثيقة المراجعة التي قدمتها Pfizer إلى FDA التي على أساسها أعطيت ضوء أخضر لتوسيع تصريح الطوارئ أيضا للأطفال الذين تتراوح أعمارهم بين 12-15 (الفقرة1)
1.
بشكل ينافي بروتوكول الدراسة لدى الأطفال (الفقرة 2 ، 3) ، يكشف لنا عن النتائج المتعلقة ، بما في ذلك انتهاكات البروتوكول الذي وضعته شركة Pfizer نفسها ، ولا يقل خطورة ، وتصميم بروتوكول التجربة بطريقة تسمح للشركة بتقديم نتائج إيجابية قدر الإمكان في شروط سلامة اللقاح عند الأطفال.
2.
2.
انتهاك شروط البروتوكول- كيف تم إشراك أطفال مصابين بأمراض نفسية في الدراسة؟
وفقا لوثيقة المراجعة التي قدمتها شركة Pfizer إلى إدارة الأغذية والعقاقير (FDA) عانى 4 من الأطفال البالغ عددهم 1131 في ذراع الدراسة الذين تلقوا لقاح Pfizer-BioNTech COVID-19 من أحداث سلبية خطيرة(SAEs)
3.
وفقا لوثيقة المراجعة التي قدمتها شركة Pfizer إلى إدارة الأغذية والعقاقير (FDA) عانى 4 من الأطفال البالغ عددهم 1131 في ذراع الدراسة الذين تلقوا لقاح Pfizer-BioNTech COVID-19 من أحداث سلبية خطيرة(SAEs)
3.
أي الأحداث التي فيها على الأقل معيار واحد تم استيفاؤه: تسبب في الوفاة ، أو يهدد الحياة ، أو يتطلب دخول المستشفى أو إطالة فترة الاستشفاء الحالية ، أو يؤدي إلى إعاقة / عجز مستمر ، أو تشوه خلقي / عيب خلقي.
من بين هؤلاء الأطفال الأربعة ، عانى ثلاثة من الاكتئاب الشديد
4.
من بين هؤلاء الأطفال الأربعة ، عانى ثلاثة من الاكتئاب الشديد
4.
هذه نتيجة مقلقة للغاية لأنها تعني أن 1 من كل 350-400 طفل قد يعاني من اكتئاب حاد ويحتاج إلى دخول المستشفى.
لطمأنتنا لاحظت Pfizer في وثيقة المراجعة الخاصة بها أنه في الواقع كان لدى الأطفال الثلاثة تشخيص سابق للقلق والاكتئاب.
6.
لطمأنتنا لاحظت Pfizer في وثيقة المراجعة الخاصة بها أنه في الواقع كان لدى الأطفال الثلاثة تشخيص سابق للقلق والاكتئاب.
6.
و أوضحوا ان لدى الثلاثة مثبط انتقائي لاسترداد السيروتونين (SSRI) بدأ بغضون شهر إلى 2 شهر قبل التطعيم.
وأوضحوا أن تفاقم أفكار انتحارية مع العلاج الأولي ل (SSRI) لدى المراهقين يعتبر خطر معترف به ويقدم تفسير معقول لتفاقم الاكتئاب لدى المتلقي. بناء عليه لا يلقي اللوم على اللقاح.
7.
وأوضحوا أن تفاقم أفكار انتحارية مع العلاج الأولي ل (SSRI) لدى المراهقين يعتبر خطر معترف به ويقدم تفسير معقول لتفاقم الاكتئاب لدى المتلقي. بناء عليه لا يلقي اللوم على اللقاح.
7.
ما مشكلة هذا التفسير؟
مشكلتان:
1.الادعاء بأن SSRIs التي تلقاها الأطفال كتفسير بديل لتدهور الحالة العقلية للأطفال أمر مشكوك فيه. وفقا للأدبيات العلمية فإن تفاقم حالة الانتحار والحالة العقلية يحدثان مباشرة في بداية العلاج بمضادات الاكتئاب ، عادةً في الأسبوعين الأولين
8.
مشكلتان:
1.الادعاء بأن SSRIs التي تلقاها الأطفال كتفسير بديل لتدهور الحالة العقلية للأطفال أمر مشكوك فيه. وفقا للأدبيات العلمية فإن تفاقم حالة الانتحار والحالة العقلية يحدثان مباشرة في بداية العلاج بمضادات الاكتئاب ، عادةً في الأسبوعين الأولين
8.
بالتأكيد ليس أكثر من شهر بعد بدء العلاج وهو الوقت الذي تبدأ فيه في رؤية التحسن. في الواقع العكس صحيح: إذا لم يكن هناك تحسن في غضون 4أسابيع يتم استبدال الدواء.
2.الأهم من ذلك وفقا لبروتوكول الدراسة لا ينبغي تضمين من لديهم تشخيص نفسي في الدراسة اصلا (صفحة 41 البروتوكول).
9.
2.الأهم من ذلك وفقا لبروتوكول الدراسة لا ينبغي تضمين من لديهم تشخيص نفسي في الدراسة اصلا (صفحة 41 البروتوكول).
9.
و يعد هذا انتهاك صارخ للبروتوكول الذي وضعته الشركة نفسها ووافقت عليه FDA. إن التضمين لمثل هذا الانتهاك شديد: إذا كانت شركة فايزر مهملة جدا لدرجة أنها شملت أشخاصا ذوي خلفية نفسية في التجربة على عكس البروتوكول الذي أنشأوه بأنفسهم - فهذا يعني أن رفاهية الأشخاص ليست همهم الرئيسي.
11.
11.
كما ذكرت Pfizer في البروتوكول: قد يزيد مثل هذه الخلفية من مخاطر المشاركة في الدراسة. وإذ لم يلتزموا بالأخلاقيات في اختيار الأشخاص فمن يستطيع أن يؤكد لنا أنهم يلتزمون بالأخلاقيات في أقسام أخرى من الدراسة على سبيل المثال تحليل النتائج؟
12.
12.
تصميم البروتوكول بطريقة تسمح للشركة بتقديم نتائج إيجابية فيما يتعلق بسلامة اللقاح
في معيارين على الأقل يبدو أن الشركة صممت بروتوكول بحيث يسمح بتقديم نتائج إيجابية قدر الإمكان فيما يتعلق بسلامة اللقاح لدى الأطفال وتقلل من إدراج الأحداث الضائرة الشديدة في التقرير .
13.
في معيارين على الأقل يبدو أن الشركة صممت بروتوكول بحيث يسمح بتقديم نتائج إيجابية قدر الإمكان فيما يتعلق بسلامة اللقاح لدى الأطفال وتقلل من إدراج الأحداث الضائرة الشديدة في التقرير .
13.
تعتبر فترة المتابعة ل6 أشهر قصيرة جدا مقارنة بوقت المتابعة المعتاد في دراسات المرحلة 3 للقاحات. وفقا لـ FDA يجب أن تستمر المرحلة 3 في دراسات اللقاح ما بين سنة وأربع سنوات ( 4 ).
ومع ذلك يتبين من وثيقة مراجعة شركة Pfizer أن الشركة لم تكمل حتى فترة المتابعة القصيرة نسبيًا هذه.
15.
ومع ذلك يتبين من وثيقة مراجعة شركة Pfizer أن الشركة لم تكمل حتى فترة المتابعة القصيرة نسبيًا هذه.
15.
كيف اصبح هذا ممكنا؟
في صفحة 114 من بروتوكول الدراسة في فصل يتناول التوقيت الذي سيتم فيه إجراء التحليلات الإحصائية حددتPfizer عدد من النقاط الزمنية لغرض إجراء هذه التحليلات. في حين أن أقصى فترة زمنية لرصد الأحداث الضائرة الشديدة في مجتمع الدراسة العام هي ستة أشهر (القسم 7)
17.
في صفحة 114 من بروتوكول الدراسة في فصل يتناول التوقيت الذي سيتم فيه إجراء التحليلات الإحصائية حددتPfizer عدد من النقاط الزمنية لغرض إجراء هذه التحليلات. في حين أن أقصى فترة زمنية لرصد الأحداث الضائرة الشديدة في مجتمع الدراسة العام هي ستة أشهر (القسم 7)
17.
بمعنى آخر ، يبدو أن البروتوكول مصمم بطريقة تجعل المراجعة المقدمة إلى FDA ستشمل فقط الأحداث الضائرة الخطيرة التي ظهرت خلال الشهر الأول بعد التطعيم.
في الواقع ، تستمر متابعة الأحداث الضائرة 5لمدة 5 أشهر أخرى ولكن أي حدث ضار سيتم اكتشافه خلال هذه الأشهر
19.
في الواقع ، تستمر متابعة الأحداث الضائرة 5لمدة 5 أشهر أخرى ولكن أي حدث ضار سيتم اكتشافه خلال هذه الأشهر
19.
أو حدث ضار تمت ملاحظته خلال الشهر الأول ولكن تم تعريفه على أنه غير خطير ويتفاقم خلال الأشهر التالية (أو سيتغير التشخيص) - فإنه لن يظهر في تقرير المراجعة
المعنى الضمني لهذه الممارسة هو أن الأحداث الخطيرة قد لا تظهر في التقرير الذي على أساسه تصدر FDA إذن طوارئ للأطفال
20.
المعنى الضمني لهذه الممارسة هو أن الأحداث الخطيرة قد لا تظهر في التقرير الذي على أساسه تصدر FDA إذن طوارئ للأطفال
20.
لذا فإن المتابعة المستمرة حتى لو تم نشرها بعد بضعة أشهر أو سنوات من الترخيص المؤقت لن يساعد الأطفال الذين سيتعرضون للأذى أو الموت بعد الضوء الأخضر من FDA.
21.
21.
تصميم البروتوكول بحيث يمكن تجاهل تشخيص الأحداث الضائرة الخطيرة الواردة في المستشفيات غير المرتبطة بموقع الدراسة.
ضمن شروط مقاييس النتائج في بروتوكول الدراسة ، كما هو معروض في Clinicaltrials.gov قررت Pfizer أن فريق البحث الذي اختارته سيكون هو الذي يحدد الأحداث السلبية
22.
ضمن شروط مقاييس النتائج في بروتوكول الدراسة ، كما هو معروض في Clinicaltrials.gov قررت Pfizer أن فريق البحث الذي اختارته سيكون هو الذي يحدد الأحداث السلبية
22.
لماذا يعتبر هذا مشكلة؟
لأن مثل هذا التحديد يعني أنه إذا عانى مشارك من أحداث سلبية خطيرة وتم علاجه خارج المشفى الذي يعمل كموقع للبحث فالتشخيص الذي أجراه الأطباء المعالجون في المشفى يعتبر غير ذي صلة. وبهذه الطريقة سمحت لفريقها بالفعل بتحديد ماهية التشخيص حتى لا يربكهم.
24.
لأن مثل هذا التحديد يعني أنه إذا عانى مشارك من أحداث سلبية خطيرة وتم علاجه خارج المشفى الذي يعمل كموقع للبحث فالتشخيص الذي أجراه الأطباء المعالجون في المشفى يعتبر غير ذي صلة. وبهذه الطريقة سمحت لفريقها بالفعل بتحديد ماهية التشخيص حتى لا يربكهم.
24.
بعيدا عن النقد الشديد الموجه إلى فايزر ، يثير التحليل والمقارنة أسئلة جدية لFDA نفسها:
•كيف يمكن أن تكون FDA وافقت حتى على بروتوكول يسمح بمثل هذه التلاعبات؟
•لماذا سمحت FDA للشركة بإجراء تحليل بيانات وتقديم طلب تصريح الطوارئ للأطفال بعد فترة متابعة قصيرة هذه 30 يومًا فقط؟
25.
•كيف يمكن أن تكون FDA وافقت حتى على بروتوكول يسمح بمثل هذه التلاعبات؟
•لماذا سمحت FDA للشركة بإجراء تحليل بيانات وتقديم طلب تصريح الطوارئ للأطفال بعد فترة متابعة قصيرة هذه 30 يومًا فقط؟
25.
•ما الذي جعل FDA حريصة جدا على الموافقة على تصريح الطوارئ للأطفال؟ لماذا تمنح هذه الموافقة بناء على تقرير سلامة لم يتم "طهيه" حتى منتصف الطريق؟ فبعد كل شيء لا توجد حالة طوارئ للأطفال.
•لم لم تعالج FDA هذه التلاعبات والانتهاكات للبروتوكول بعد أن قدمت الشركة مراجعتها؟
26.
•لم لم تعالج FDA هذه التلاعبات والانتهاكات للبروتوكول بعد أن قدمت الشركة مراجعتها؟
26.
يافا شير راز ، دكتوراه ، باحثة في مجال التواصل بالمخاطر وزميلة تدريس في جامعة حيفا والمركز متعدد التخصصات هرتسليا في إسرائيل. تم نشر هذا المقال على موقع American Frontline Doctors .
tinyurl.com
tinyurl.com
جاري تحميل الاقتراحات...