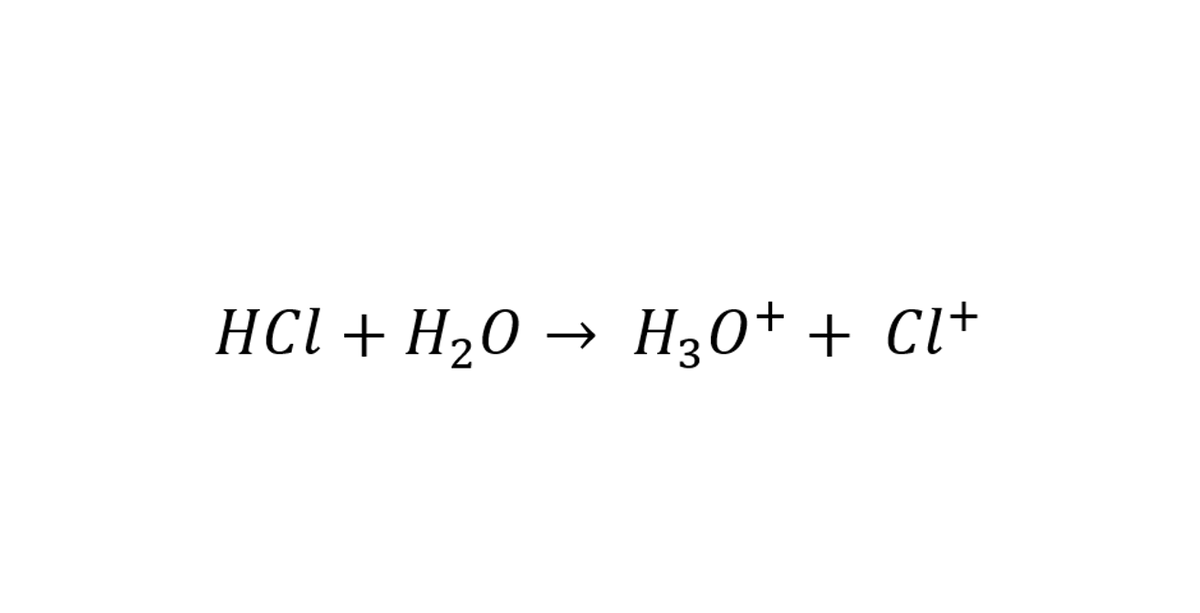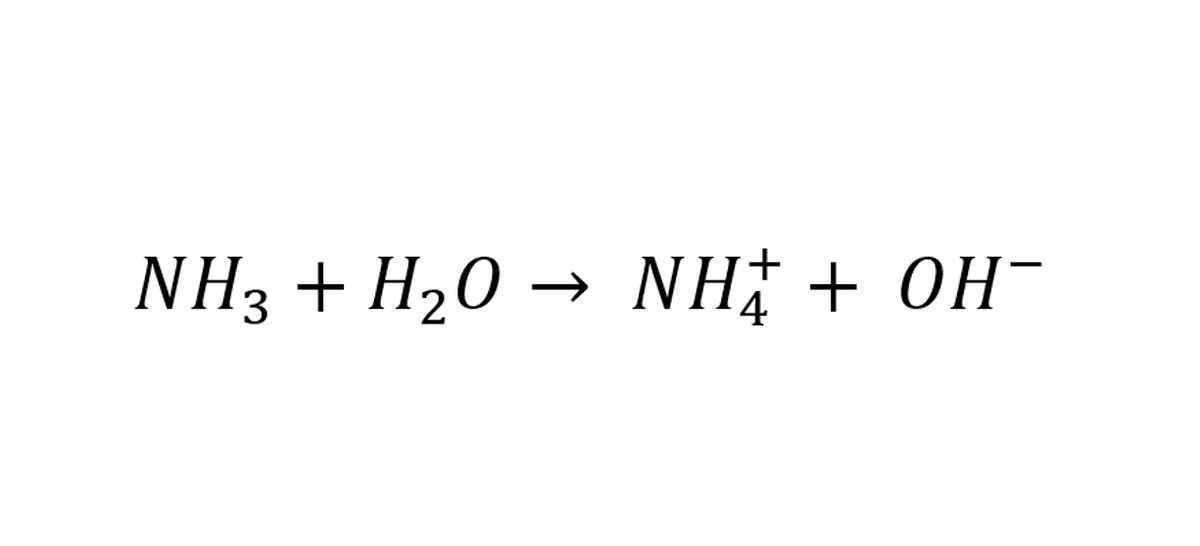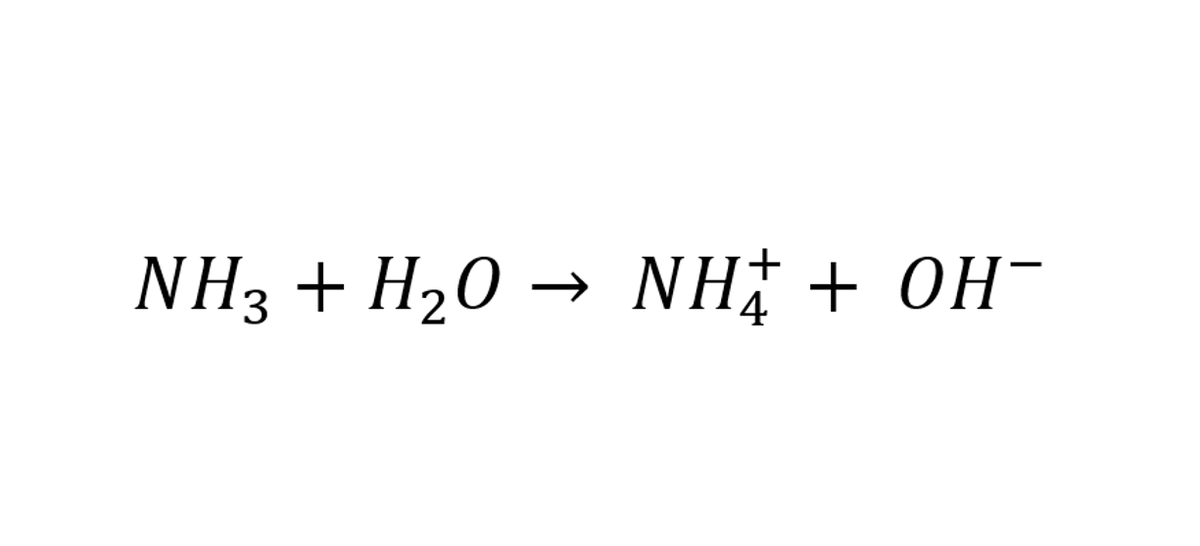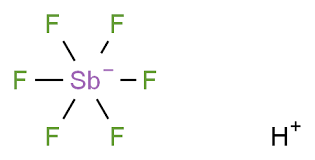1. التساؤلات:
من أول من أكتشف الحمض كمركب كيميائي؟ ما هو المركب الحمضي؟ لماذا الأحماض القوية تحرق السكر وتحوله الى لون أسود؟ لماذا الليمون لا يحرق وهو حامض؟
من أول من أكتشف الحمض كمركب كيميائي؟ ما هو المركب الحمضي؟ لماذا الأحماض القوية تحرق السكر وتحوله الى لون أسود؟ لماذا الليمون لا يحرق وهو حامض؟
ما أضعف حمض وما اقوى حمض على الإطلاق؟ ولماذا هو ضعيف أو قوي؟ أين نجد الأحماض في حياتنا؟
سأدخل إلى منجم المعلومات (البحوث) وآتي بعد الاستكشاف والفهم بالمجوهرات (المعلومات) لتستمتعوا بها. ⛏️💎
سأدخل إلى منجم المعلومات (البحوث) وآتي بعد الاستكشاف والفهم بالمجوهرات (المعلومات) لتستمتعوا بها. ⛏️💎
2. تاريخ الأحماض:
في هذا القسم سنجيب على سؤال: (من أول من أكتشف الحمض كمركب كيميائي؟)
منذ قديم الزمان صنف العلماء المواد بحسب خصائصها، والمادة الحمضية لها خصائصها التي سنكتشفها معا.
الأحماض موجودة في الطبيعة وتاريخها مرتبط بتاريخ الطبيعة، والليمون كمثال بسيط له الطعم الحامض...
في هذا القسم سنجيب على سؤال: (من أول من أكتشف الحمض كمركب كيميائي؟)
منذ قديم الزمان صنف العلماء المواد بحسب خصائصها، والمادة الحمضية لها خصائصها التي سنكتشفها معا.
الأحماض موجودة في الطبيعة وتاريخها مرتبط بتاريخ الطبيعة، والليمون كمثال بسيط له الطعم الحامض...
ومن بعد هذا التعريف الذي سنتعرف عليه في مفهوم المركب الحمضي أتت تعاريف أخرى مكملة لهذا التعريف.
3. مفهوم المركب الحمضي:
في هذا القسم سنجيب على سؤال: (ما هو المركب الحمضي؟)
العالم أرينوس لاحظ أن المركبات الأيونية كالملح أو كلوريد الصوديوم (NaCl) يتفكك ويعطي أيون الصوديوم (Na+1) وأيون الكلور (Cl-1) عندما نذوبه في الماء. "فافترض" أرينوس أن الأحماض لها نفس خاصية المركب الأيوني
في هذا القسم سنجيب على سؤال: (ما هو المركب الحمضي؟)
العالم أرينوس لاحظ أن المركبات الأيونية كالملح أو كلوريد الصوديوم (NaCl) يتفكك ويعطي أيون الصوديوم (Na+1) وأيون الكلور (Cl-1) عندما نذوبه في الماء. "فافترض" أرينوس أن الأحماض لها نفس خاصية المركب الأيوني
بشكل مختصر الحمض هو الذي يفقد هيدروجين.
وهكذا تم تعرف الأحماض بشكل علمي موسع وبشكل أفضل لمعرفة إن كان هذا المركب حمضي أم لا.
وهكذا تم تعرف الأحماض بشكل علمي موسع وبشكل أفضل لمعرفة إن كان هذا المركب حمضي أم لا.
4. قوة الأحماض:
في هذا القسم سنجيب على هذه الأسئلة: (ما اقوى حمض على الإطلاق وما أضعف حمض؟ ولماذا هو قوي أو ضعيف؟ لماذا بعض الأحماض تحرق السكر وتحوله الى لون أسود؟ لماذا الليمون لا يحرق السكر وهو حامض؟)
في هذا القسم سنجيب على هذه الأسئلة: (ما اقوى حمض على الإطلاق وما أضعف حمض؟ ولماذا هو قوي أو ضعيف؟ لماذا بعض الأحماض تحرق السكر وتحوله الى لون أسود؟ لماذا الليمون لا يحرق السكر وهو حامض؟)
يمكن حساب (قوة التحلل) عن طريق معادلة رياضية تسمى حساب ثابت التحلل أو Kpa ويتم بشكل مختصر عن طريق قسمة النواتج لتفكك الحمض على المتفاعلات. ولكن الأحماض الفائقة تفوق هذه المعادلة (أي أقوى من أن تقاس بهذه المعادلة لقوة تفككها) ولهذا تسمى بأحماض فائقة.
youtube.com
في هذا الفيديو نرى تفاعلات أقوى حمض في العالم مع مواد مختلفة... في الدقيقة 1:24 نرى طريقة تخزين وفتح هذا الحمض، الدقيقة 5:43 نرى تفاعلات الحمض مع القفازات المختلفة التي ربما ترتديها عندما تتعامل مع هذا الحمض!
في هذا الفيديو نرى تفاعلات أقوى حمض في العالم مع مواد مختلفة... في الدقيقة 1:24 نرى طريقة تخزين وفتح هذا الحمض، الدقيقة 5:43 نرى تفاعلات الحمض مع القفازات المختلفة التي ربما ترتديها عندما تتعامل مع هذا الحمض!
في الدقيقة 9:18 نرى تفاعل هذا الحمض مع الجلد والدقيقة 13:35 توضح تفاعل الحمض مع الماء.
هذا الفيديو يوضح أن قوة الحمض (مدى إعطاءه للبروتونات) لا تعني بالضرورة قوة تآكله للمواد الأخرى.
أما أضعف حمض فهو حمض الفسفوريك وله هذه الصيغة الكيميائية (H3PO4).
هذا الفيديو يوضح أن قوة الحمض (مدى إعطاءه للبروتونات) لا تعني بالضرورة قوة تآكله للمواد الأخرى.
أما أضعف حمض فهو حمض الفسفوريك وله هذه الصيغة الكيميائية (H3PO4).
لنجيب على السؤال الأخير (لماذا بعض الأحماض تحرق السكر وتحوله الى لون أسود؟ لماذا الليمون لا يحرق السكر وهو حامض؟) بهذا الجواب:
السكر يحتوي على كربون، أكسجين، هيدروجين، وله هذه الصيغة الكيميائية “C12H22O11".
السكر يحتوي على كربون، أكسجين، هيدروجين، وله هذه الصيغة الكيميائية “C12H22O11".
الليمون لا يحتوي فقط على حمض (وهو حمض الليمون أو citric acid) بل يحتوي على سكريات وفيتامينات ومعادن لهذا السبب لا يمكن أن يؤثر على السكر لأنه يحتوي على السكر أساسا.
ولكن عندما نضيف حمض الكبريتيك (Sulfuric acid) المركز الى السكر سيتكون تفاعل مشهور وله اسم (الثعبان الأسود)
الموضح في هذا الفيديو : youtube.com
الموضح في هذا الفيديو : youtube.com
حمض الكبريتيك المركز يعتبر حمض قوي وله خاصية التنشيف (بمعنى أنه ينزع جزيئات الماء من السكر الذي يحتوي على هيدروجين و أكسجين، فيبقى الكاربون الذي له اللون الأسود).
5. وجود الأحماض في الطبيعة:
أقرب مثال والذي يحدث في جسمك الآن هو حمض المعدة وهو حمض الهيدروكلوريك (HCl) ويعتبر حمض قوي جدا ليؤدي وظيفة تفكيك الطعام الى جزيئات صغيرة جدا وأيضا يقوم بالحفاظ على المعدة من مسببات الأمراض كالفيروسات والبكتيريا.
أقرب مثال والذي يحدث في جسمك الآن هو حمض المعدة وهو حمض الهيدروكلوريك (HCl) ويعتبر حمض قوي جدا ليؤدي وظيفة تفكيك الطعام الى جزيئات صغيرة جدا وأيضا يقوم بالحفاظ على المعدة من مسببات الأمراض كالفيروسات والبكتيريا.
يستطيع هذا الحمض أن يجعل العظام وغيرها من المواد الصلبة تتحلل ولكن يوجد طبقة عازلة في المعدة تحميك من هذه الاضرار، وفي الحقيقة أن المعدة تحتوي على نسبة بسيطة من هذا الحمض ويوجد مركبات أخرى وهي كلوريد الصوديوم و كلوريد البوتاسيوم.
عندما تقل كمية الحمض في معدتك من الممكن أن تسبب بعض الأعراض ومنها:
1- صعوبة الهضم.
2- الشعور بالغثيان والاستفراغ.
3- تساقط الشعر.
4- حرقة المعدة.
وغيرها من الأعراض.
1- صعوبة الهضم.
2- الشعور بالغثيان والاستفراغ.
3- تساقط الشعر.
4- حرقة المعدة.
وغيرها من الأعراض.
أما مسببات نقص هذا الحمض في المعدة ربما يكون بعض الأدوية أو الإجهاد النفسي والضغط. ولكي تعالج هذه المشكلة ربما تحتاج إلى بعض التقنيات التي تساعدك في اخفاض التوتر النفسي أو التغذية السليمة.
6. المصادر العلمية.
(ستعرض في الجزء الثاني من الكتاب)
(ستعرض في الجزء الثاني من الكتاب)
جاري تحميل الاقتراحات...