مع تطرق العديد للحديث في هذه الأيام عن التجارب السريرية فلابد من الحديث عن ماهية هذه التجارب.
في هذا الثريد سنتحدث عن تصميم التجارب السريرية ومراحلها مرورًا بالطرق الاستقصائية للأدوية الجديدة ووصولا لعملية الموافقة من إدارة الغذاء والدواء.
إعداد: @Noufmarshdi
في هذا الثريد سنتحدث عن تصميم التجارب السريرية ومراحلها مرورًا بالطرق الاستقصائية للأدوية الجديدة ووصولا لعملية الموافقة من إدارة الغذاء والدواء.
إعداد: @Noufmarshdi
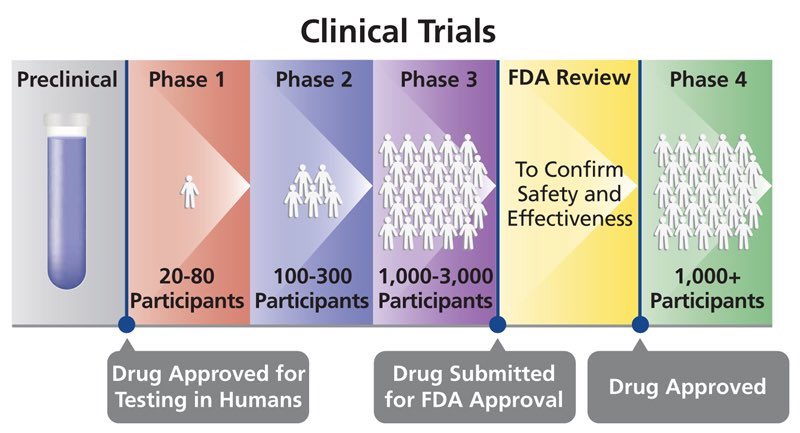
المرحلة الأولى:
المشاركون في الدراسة: 20 إلى 100 متطوع سليم أو الأشخاص المصابين بالمرض.
مدة الدراسة: عدة شهور
الغرض: السلامة والجرعة
ينتقل حوالي 70٪ من الأدوية إلى المرحلة التالية.
المشاركون في الدراسة: 20 إلى 100 متطوع سليم أو الأشخاص المصابين بالمرض.
مدة الدراسة: عدة شهور
الغرض: السلامة والجرعة
ينتقل حوالي 70٪ من الأدوية إلى المرحلة التالية.
المرحلة الثانية:
المشاركون في الدراسة: عدة مئات من الأشخاص المصابين بالمرض.
مدة الدراسة: من عدة أشهر إلى سنتين الغرض: الفعالية والآثار الجانبية
ينتقل حوالي 33٪ من الأدوية إلى المرحلة التالية.
المشاركون في الدراسة: عدة مئات من الأشخاص المصابين بالمرض.
مدة الدراسة: من عدة أشهر إلى سنتين الغرض: الفعالية والآثار الجانبية
ينتقل حوالي 33٪ من الأدوية إلى المرحلة التالية.
المرحلة الثالثة:
المشاركون في الدراسة: 300 إلى 3000 متطوع يعانون من المرض أو الحالة
مدة الدراسة: من 1 إلى 4 سنوات
الغرض: فعالية الدواء ورصد الأعراض الجانبية
ينتقل ما يقرب 25-30 ٪ من الأدوية إلى المرحلة التالية.
المشاركون في الدراسة: 300 إلى 3000 متطوع يعانون من المرض أو الحالة
مدة الدراسة: من 1 إلى 4 سنوات
الغرض: فعالية الدواء ورصد الأعراض الجانبية
ينتقل ما يقرب 25-30 ٪ من الأدوية إلى المرحلة التالية.
المرحلة الرابعة:
المشاركون في الدراسة: عدة آلاف من المتطوعين المصابين بالمرض / الحالة
الغرض: السلامة والفعالية
المشاركون في الدراسة: عدة آلاف من المتطوعين المصابين بالمرض / الحالة
الغرض: السلامة والفعالية
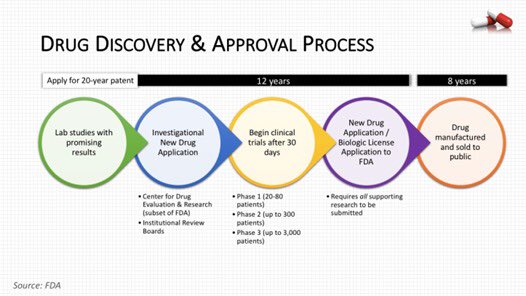
طرق الاستقصائية للأدوية الجديدة:
يجب على مطوري الأدوية ، أو الرعاة ، تقديم طلب بحث دوائي جديد investigational New Drug
(IND) إلى إدارة الغذاء والدواء قبل بدء البحث السريري.
يجب على مطوري الأدوية ، أو الرعاة ، تقديم طلب بحث دوائي جديد investigational New Drug
(IND) إلى إدارة الغذاء والدواء قبل بدء البحث السريري.
في تطبيق IND ، يجب على المطورين تضمين مايلي:
•بيانات دراسة الحيوانات و السمية (الآثار الجانبية التي تسبب ضررا كبيرا)
•معلومات التصنيع
•البروتوكولات السريرية (الخطط الدراسية) للدراسات التي سيتم إجراؤها
•بيانات من أي بحث بشري سابق
•معلومات عن الباحث investigator
•بيانات دراسة الحيوانات و السمية (الآثار الجانبية التي تسبب ضررا كبيرا)
•معلومات التصنيع
•البروتوكولات السريرية (الخطط الدراسية) للدراسات التي سيتم إجراؤها
•بيانات من أي بحث بشري سابق
•معلومات عن الباحث investigator
طلب مساعدة ادارة الغذاء والدواء
لدى مطوروا الأدوية الحرية في طلب المساعدة من إدارة الغذاء والدواء في أي مرحلة من عملية تطوير الدواء ، بما في ذلك:
لدى مطوروا الأدوية الحرية في طلب المساعدة من إدارة الغذاء والدواء في أي مرحلة من عملية تطوير الدواء ، بما في ذلك:
•تطبيق ما قبل IND لمراجعة وثائق إرشادات إدارة الغذاء والدواء والحصول على إجابات للأسئلة التي قد تساعد في تعزيز أبحاثهم
•بعد المرحلة الثانية ، للحصول على إرشادات حول تصميم دراسات المرحلة الثالثة الكبيرة
•في أي وقت أثناء العملية ، للحصول على تقييم لتطبيق IND
•بعد المرحلة الثانية ، للحصول على إرشادات حول تصميم دراسات المرحلة الثالثة الكبيرة
•في أي وقت أثناء العملية ، للحصول على تقييم لتطبيق IND
وعلى الرغم من أن إدارة الأغذية والأدوية تقدم مساعدة فنية مكثفة ، إلا أن مطوري الأدوية ليسوا مطالبين بأخذ اقتراحات إدارة الغذاء والدواء.
طالما أن التجارب الإكلينيكية مصممة بعناية ، وتعكس ما يعرفه المطورون عن المنتج ، وحماية المشاركين ، وتلبية المعايير الفيدرالية ، فإن إدارة الغذاء والدواء تسمح
بخطوط عرض واسعة في تصميم التجارب السريرية.
بخطوط عرض واسعة في تصميم التجارب السريرية.
بعد تقديم طلب IND إلى إدارة الغذاء والدواء يقوم فريق يسمى فريق مراجعة FDA IND بمراجعة وتقييم الطلب، ويتكون هذا الفريق من مجموعة من المتخصصين في المجالات العلمية المختلفة. كل عضو لديه مسؤوليات مختلفة.
•مدير المشروع: ينسق أنشطة الفريق طوال عملية المراجعة ، وهو جهة الاتصال الأساسية للراعي.
•المسؤول الطبي: يراجع جميع معلومات وبيانات الدراسة السريرية قبل وأثناء وبعد اكتمال الدراسة.
•المسؤول الطبي: يراجع جميع معلومات وبيانات الدراسة السريرية قبل وأثناء وبعد اكتمال الدراسة.
•إحصائي: يفسر تصميمات وبيانات التجارب السريرية ، ويعمل بشكل وثيق مع المسؤول الطبي لتقييم البروتوكولات وبيانات السلامة والفعالية.
• صيدلي: يستعرض الدراسات قبل السريرية.
• صيدلي: يستعرض الدراسات قبل السريرية.
• اختصاصي الحركية الدوائية: يركز على امتصاص الدواء وتوزيعه وعمليات الأيض والإفرازو بيانات مستوى الدواء الدم في فترات زمنية مختلفة من التجارب السريرية ، كوسيلة لتقييم جرعات الدواء وجداول الإعطاء.
• الكيميائي: تقييم المركبات الكيميائية للدواء. يحلل كيفية صنع الدواء واستقراره ، ومراقبة الجودة، والاستمرارية ، ووجود الشوائب ، وما إلى ذلك.
• أخصائي الأحياء الدقيقة: يراجع البيانات المقدمة ، إذا كان المنتج منتجا مضادًا للميكروبات لتقييم الاستجابة عبر فئات مختلفة من الميكروبات
• أخصائي الأحياء الدقيقة: يراجع البيانات المقدمة ، إذا كان المنتج منتجا مضادًا للميكروبات لتقييم الاستجابة عبر فئات مختلفة من الميكروبات
تستجيب إدارة الغذاء والدواء لطلبات IND بإحدى طريقتين:
•الموافقة على بدء التجارب السريرية.
•الإيقاف السريري لتأخير أو إيقاف التحقيق.
•الموافقة على بدء التجارب السريرية.
•الإيقاف السريري لتأخير أو إيقاف التحقيق.
يمكن لإدارة الغذاء و الدواء FDA إجراء حجز سريري لأسباب محددة ، بما في ذلك: ·تعرض المشاركون لمخاطر غير منطقية أو كبيرة.
·الباحثين غير مؤهلين
. المواد للمشاركين المتطوعين مضللة وغير دقيقة.
·لا يتضمن تطبيق IND معلومات كافية عن مخاطر التجربة.
·الباحثين غير مؤهلين
. المواد للمشاركين المتطوعين مضللة وغير دقيقة.
·لا يتضمن تطبيق IND معلومات كافية عن مخاطر التجربة.
الباحث مسؤول عن إبلاغ فريق المراجعة بالبروتوكولات الجديدة ، بالإضافة إلى الآثار الجانبية الخطيرة التي شوهدت أثناء التجربة. تضمن هذه المعلومات أن يتمكن الفريق من مراقبة التجارب بعناية بحثا عن أي مشاكل.
بعد انتهاء التجربة ، يجب على الباحثين تقديم تقارير الدراسة.
بعد انتهاء التجربة ، يجب على الباحثين تقديم تقارير الدراسة.
تستمر هذه العملية حتى يقرر الباحث الرئيسي إنهاء التجربة السريرية أو يقدم طلب تسويق. قبل تقديم طلب
التسويق ، يجب أن يكون لدى الباحث بيانات كافية من تجربتين سريريتين كبيرتين وخاضعتين للرقابة.
التسويق ، يجب أن يكون لدى الباحث بيانات كافية من تجربتين سريريتين كبيرتين وخاضعتين للرقابة.
جاري تحميل الاقتراحات...