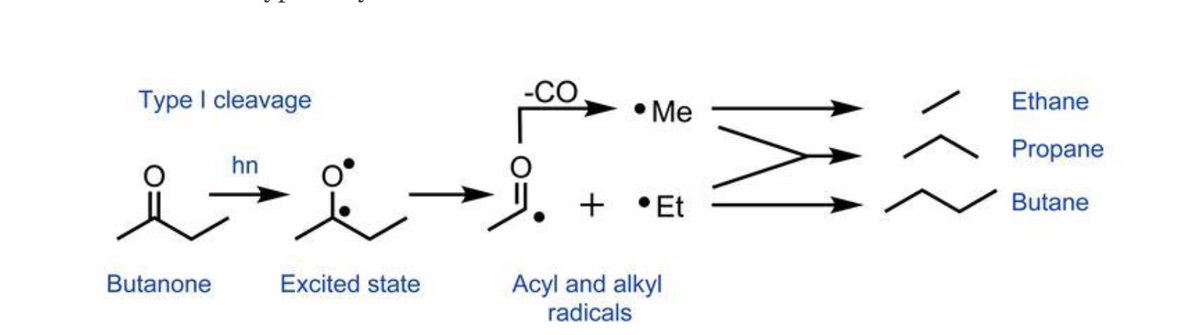
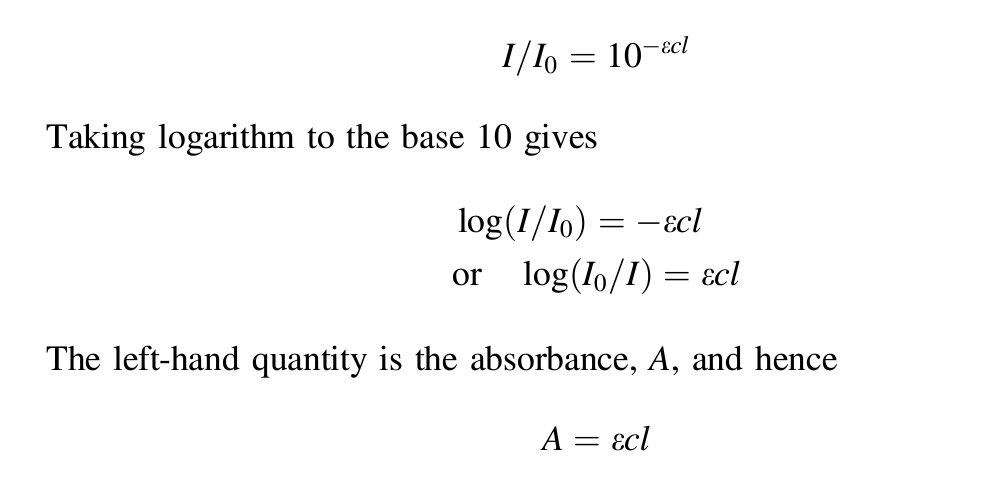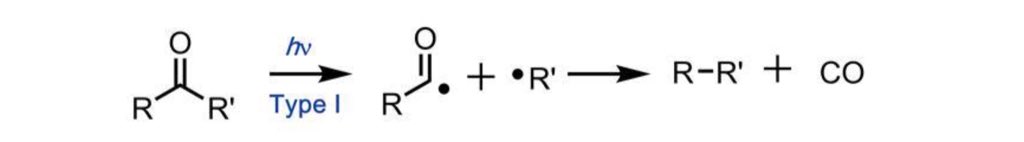مهتم بالنشاط الكيميائي للمركبات العضوية تجاهه الضوء ؟!
👇🏻 سلسلة تغريدات توضح نشأة الكيمياء الضوئية وميكانيكياتها وكيف تٌطبق عبى التفاعلات العضوية #كيمياء #معلومات_كيميائية
👇🏻 سلسلة تغريدات توضح نشأة الكيمياء الضوئية وميكانيكياتها وكيف تٌطبق عبى التفاعلات العضوية #كيمياء #معلومات_كيميائية
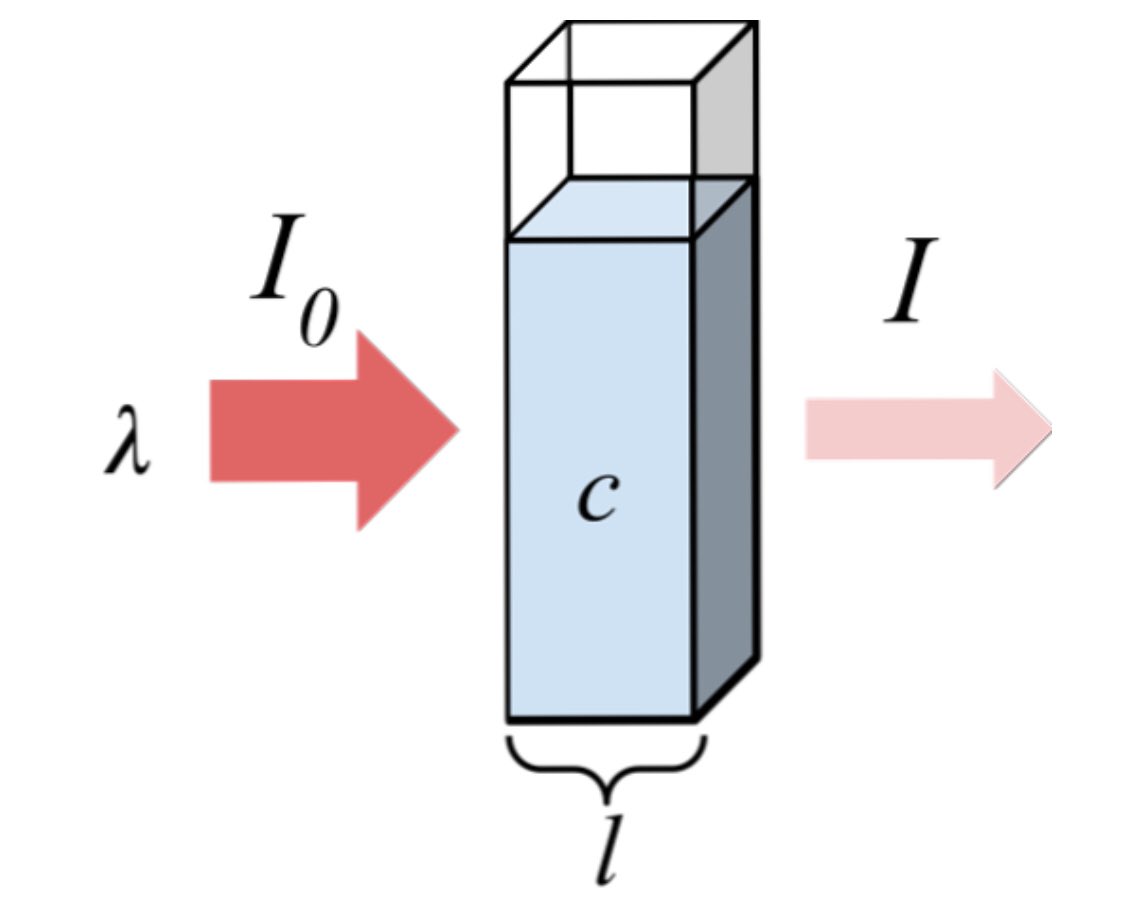
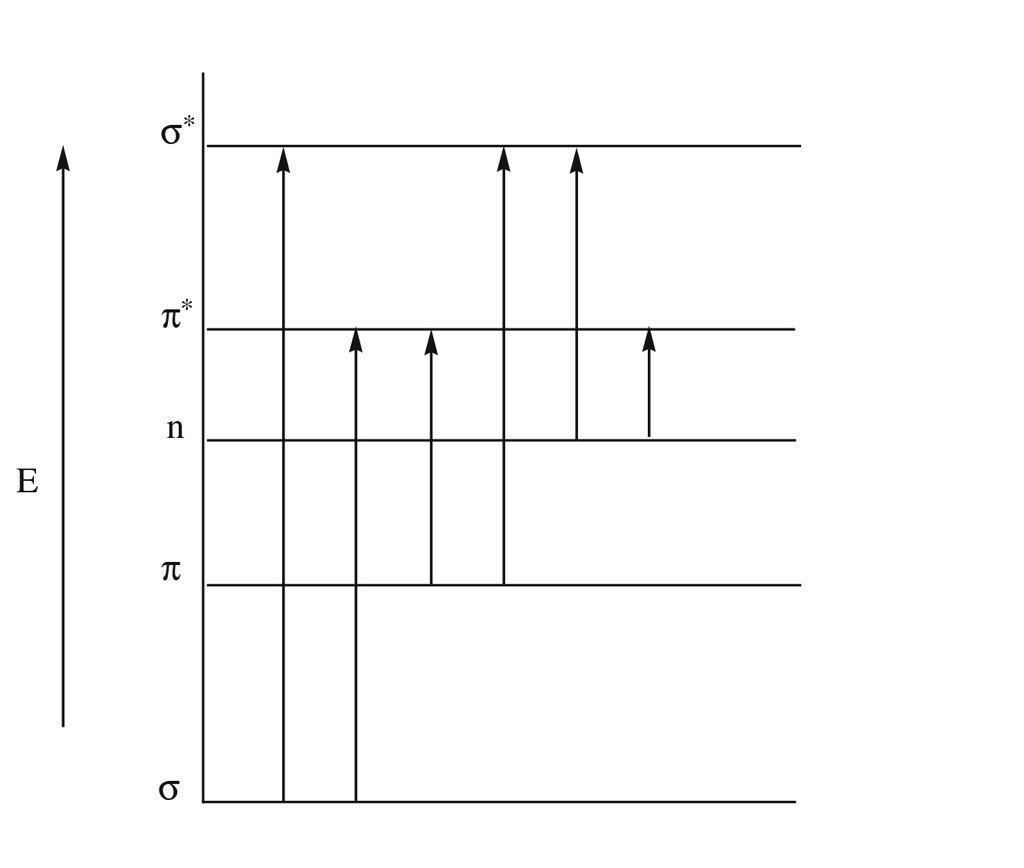
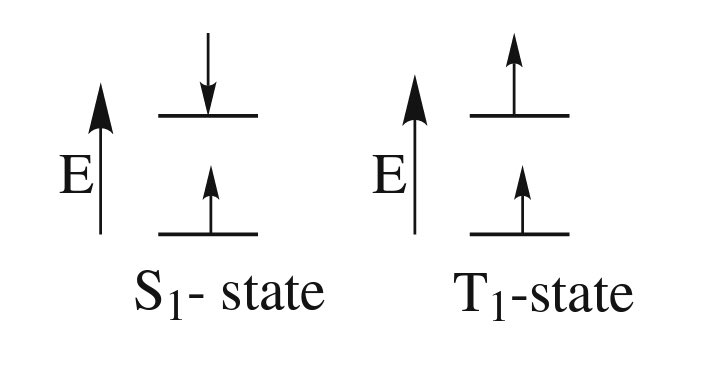
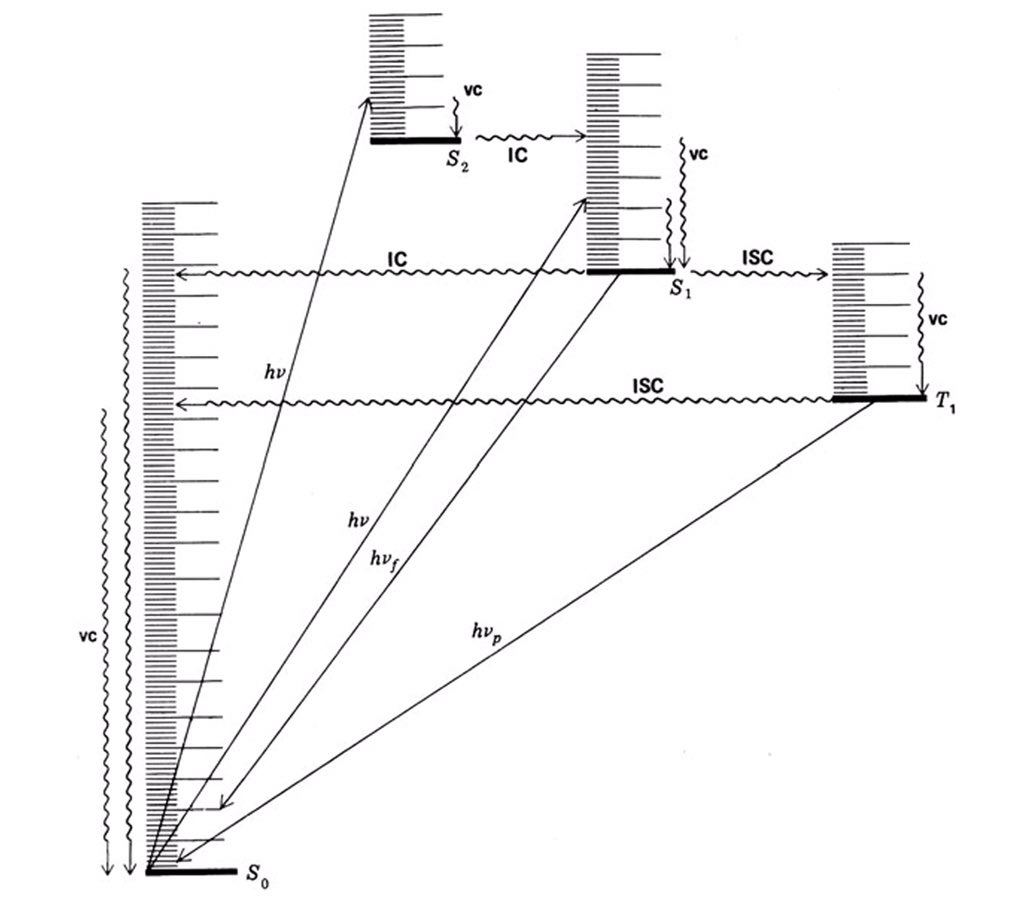
طالما الحديث يطال الانتقالات الإلكترونية فلابد الأخذ بعين الإعتبار ما يُسمى بالمغزلية التعددية ( Spin multiplicity ) والمُعطى بالمعادلة
Spin multiplicity = 2S+1
Spin multiplicity = 2S+1
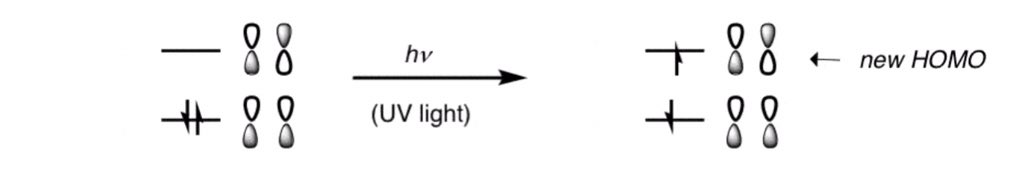
وفقاً لقاعدة الإختيار Selection rules فعند إثارة الإلكترون و إنتقاله الى LUMO فأن المغزلية التعددية لا تتغير وبالتالي
الإنتقال من الحالة الاحادية الخاملة ( S0 ) إلى الحالة الأحادية المُثارة (S1) إنتقالة مسموحة بينما هي ممنوعة لـ S0 -> T1
الإنتقال من الحالة الاحادية الخاملة ( S0 ) إلى الحالة الأحادية المُثارة (S1) إنتقالة مسموحة بينما هي ممنوعة لـ S0 -> T1
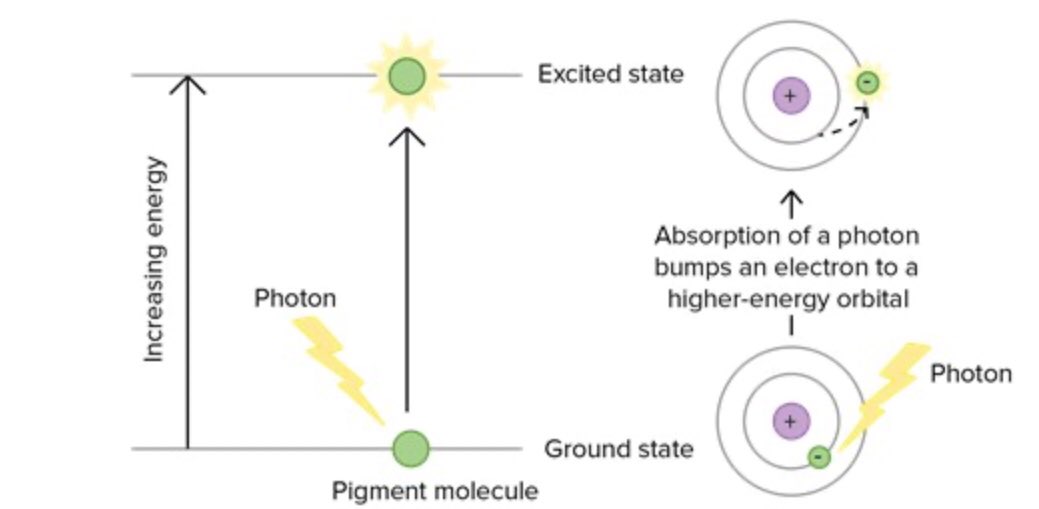
أحياناً يتم إمتصاص طاقة أعلى من S1 وقد تصل إلى S3 أو S2 وهذه الحالات عادةً لا يتم فيها التفاعل فتنتقل إلى S1 معطيه طاقة على شكل حرارة تُسمى هذه العملية Internal conversions.
أغلب التفاعلات العضوية الضوئية تتم في T1(وهناك بعض الحالات تتم في S1)لذلك للمركب العضوي خياريين إما ينبعث الضوء ويرجع الإلكترون إلى الحالة الخاملةS1 -> S0وهذه العملية تُسمىFluorescence أوينتقل الالكترون منS1 إلى T1(مستوى طاقة أقل بقليل من S1)وتُسمى هذه العمليةIntercrossing system
أما الخيار الثاني هو حدوث تفاعل كيميائي من T1 وفي هذه الحالة يتكون عندنا ال Intermidate وتركيزه هو الذي يعتمد عليه معدل التفاعل الكيميائي وليس الحالة المثارة لأن ليس كل جزيء يُثار من الممكن أن يدخل في تكوين الناتج وهنا يكون لدينا ما يُسمى Quantum Yield
وهو كمية الجزيئات المتفاعلة نسبةً إلى تلك التي تمت إثارتها
φ = عدد الجزيئات المتفاعلة عند زمن معين / عدد الفوتونات الممتصة عند نفس الزمن
وهذه القيمة عادةً تكون >١ ولكن قد تكون أعلى بسبب عدد الروابط المفككة عند تسليط الضوء.
φ = عدد الجزيئات المتفاعلة عند زمن معين / عدد الفوتونات الممتصة عند نفس الزمن
وهذه القيمة عادةً تكون >١ ولكن قد تكون أعلى بسبب عدد الروابط المفككة عند تسليط الضوء.
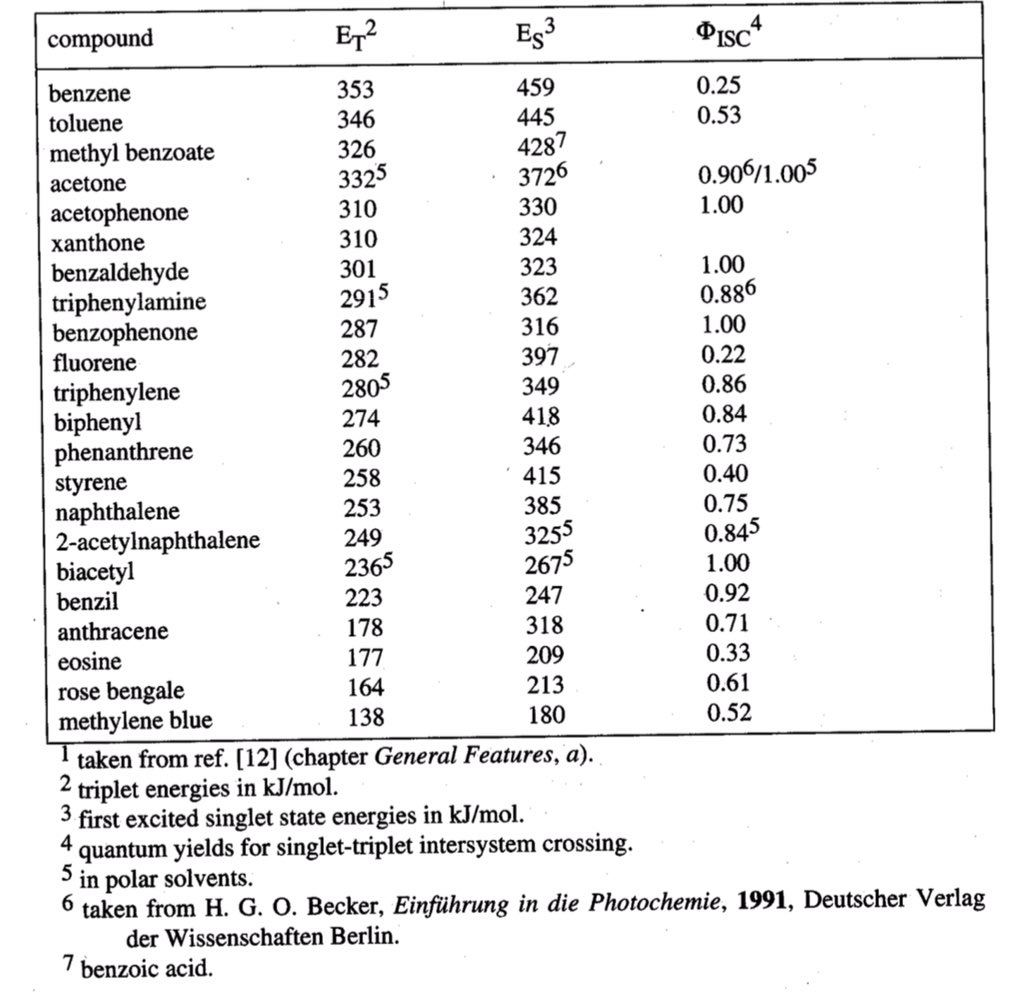
بعض الحالات المركب العضوي قد يعطي نواتج مختلفة عندما يحدث التفاعل من S1 أو T1 .. اذا كان الناتج من S1 غير مرغوب أو الانتقالة لا تحدث من S1 إلى T1 بسبب فرق الطاقة الكبير فيمكن إضافة مركب يمتص الضوء عند طول موجي آخر فينقل طاقتها إلى T1 الخاص بالمتفاعل
فتُسمى هذه العملية Photosensitization و المركب يُسمى Photosensitizer ... أحياناً هذا المركب يمتص الطاقة من T1 الخاصة بالمتفاعل إليه ويمنعه من التفاعل فتُسمى هذه العملية Quenching و المركب يُسمى Quencher.
في حالة ال Photosensitization فإن المركب Photosensitizer يمتص الضوء الىS1 ثمT1حتى ينتقل إلىT1الخاص بالمتفاعل فيجب أن تكون طاقة T1الخاصة به أعلى بقليل T1 للمتفاعل و العكس صحيح مع ال Quenching حتى تمتص الطاقة من T1 في المتفاعل لابد تكون طاقته أعلى من طاقة T1الخاص بالQuencher بقليل
جاري تحميل الاقتراحات...