حسابات المحاليل
#كفايات_كيمياء
#كفايات_كيمياء
خفف 400mL من محلول HCl تركيزه 0.2M حتى أصبح حجمه 2L . احسب مولارية المحلول الناتج
#كفايات_كيمياء
#كفايات_كيمياء
1000جرام من الماء أذيب فيه هيدروكسيد البوتاسيوم حتى أصبح تركيز المحلول 0.0625m , ما كتلة هيدروكسيد البوتاسيوم المحلول (K = 39 , O = 16 , H = 1)
#كفايات_كيمياء
#كفايات_كيمياء
احسب حجم الماء اللازم إضافته إلى 300mL من FeCl3 ليتغير نسبة تركيزه الكتلي من 0.2% إلى 0.1%
#كفايات_كيمياء
#كفايات_كيمياء
التركيز المولاري لمحلول حجمه لتر يحتوي 10g هيدروكسيد الصوديوم (Na = 23, O=16 , H =1)
#كفايات_كيمياء
#كفايات_كيمياء
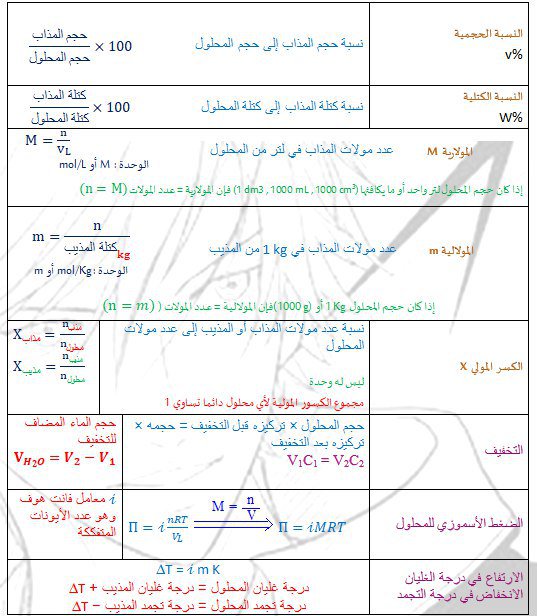
نسبة المذاب إلى المحلول أو إلى المذيب
من باب اختصار الوقت نقول المولارية = عدد المولات عندما يكون حجم المحلول لتر واحد (أو ما يكافئها)
1000 mL, 1000 cm³ , 1dm³
n = M
والمولالية تساوي المولات عندما يكون كتلة المذيب 1kg أو 1000g
n = m
#كفايات_كيمياء
1000 mL, 1000 cm³ , 1dm³
n = M
والمولالية تساوي المولات عندما يكون كتلة المذيب 1kg أو 1000g
n = m
#كفايات_كيمياء
بالنسبة لمولارية محلول معلوم الكثافة ونسبة التركيز الكتلي
المولارية = عدد مولات المذاب ÷ حجم المحلول باللتر
فكرة الحل : تستخدم افتراضات المعطيات عشان تحسب البسط والمقام
مفتاح الحل ( نفرض كتلة المحلول 100g وعليه تكون كتلة المذاب بالجرام = نسبة التركيز)
#كفايات_كيمياء
يتبع
المولارية = عدد مولات المذاب ÷ حجم المحلول باللتر
فكرة الحل : تستخدم افتراضات المعطيات عشان تحسب البسط والمقام
مفتاح الحل ( نفرض كتلة المحلول 100g وعليه تكون كتلة المذاب بالجرام = نسبة التركيز)
#كفايات_كيمياء
يتبع
نقدر نختصر ذا الكلام كله بأحد قوانين التحليل الحجمي
المولارية = الكثافة × النسبة الكتلية × 10 / الوزن الجزيئي للمذاب
ال10 ثابت
#كفايات_كيمياء
الطريقتين صحيحة والأمر راجع لكم تبغون بالافتراضات ✔
بقانون M = d%×10/M.wt ✔
كل الطرق تؤدي إلى روما ✈️
المولارية = الكثافة × النسبة الكتلية × 10 / الوزن الجزيئي للمذاب
ال10 ثابت
#كفايات_كيمياء
الطريقتين صحيحة والأمر راجع لكم تبغون بالافتراضات ✔
بقانون M = d%×10/M.wt ✔
كل الطرق تؤدي إلى روما ✈️
التركيز الفعلي يعني تركيز المحلول × عدد الأيونات
مثل محلول 0.5M MgCl2
يتفكك إلى 3 ايونات
أيونين Cl وأيون Mg
التركيز الفعلي لأيون Mg فقط
2×0.5=1
التركيز الفعلي لأيون Mg
1×0.5=0.5
التركيز، الفعلي للمحلول بأكمله
3×0.5=1.5
#كفايات_كيمياء
مثل محلول 0.5M MgCl2
يتفكك إلى 3 ايونات
أيونين Cl وأيون Mg
التركيز الفعلي لأيون Mg فقط
2×0.5=1
التركيز الفعلي لأيون Mg
1×0.5=0.5
التركيز، الفعلي للمحلول بأكمله
3×0.5=1.5
#كفايات_كيمياء
الخواص التجميعية للمحاليل
تتأثر مباشرة بالتركيز الفعلي للمحلول وهي
الارتفاع في الضغط الأسموزي ودرجة الغليان
الانخفاض في الضغط البخاري ودرجة الغليان
يعني محلول 0.1M NaCl مولاريته الفعلية 0.2
ومحلول 0.1M MgCl2 مولاريته الفعلية 0.3
نجد أن MgCl2 له الأثر الأكبر على خواص المحلول
تتأثر مباشرة بالتركيز الفعلي للمحلول وهي
الارتفاع في الضغط الأسموزي ودرجة الغليان
الانخفاض في الضغط البخاري ودرجة الغليان
يعني محلول 0.1M NaCl مولاريته الفعلية 0.2
ومحلول 0.1M MgCl2 مولاريته الفعلية 0.3
نجد أن MgCl2 له الأثر الأكبر على خواص المحلول
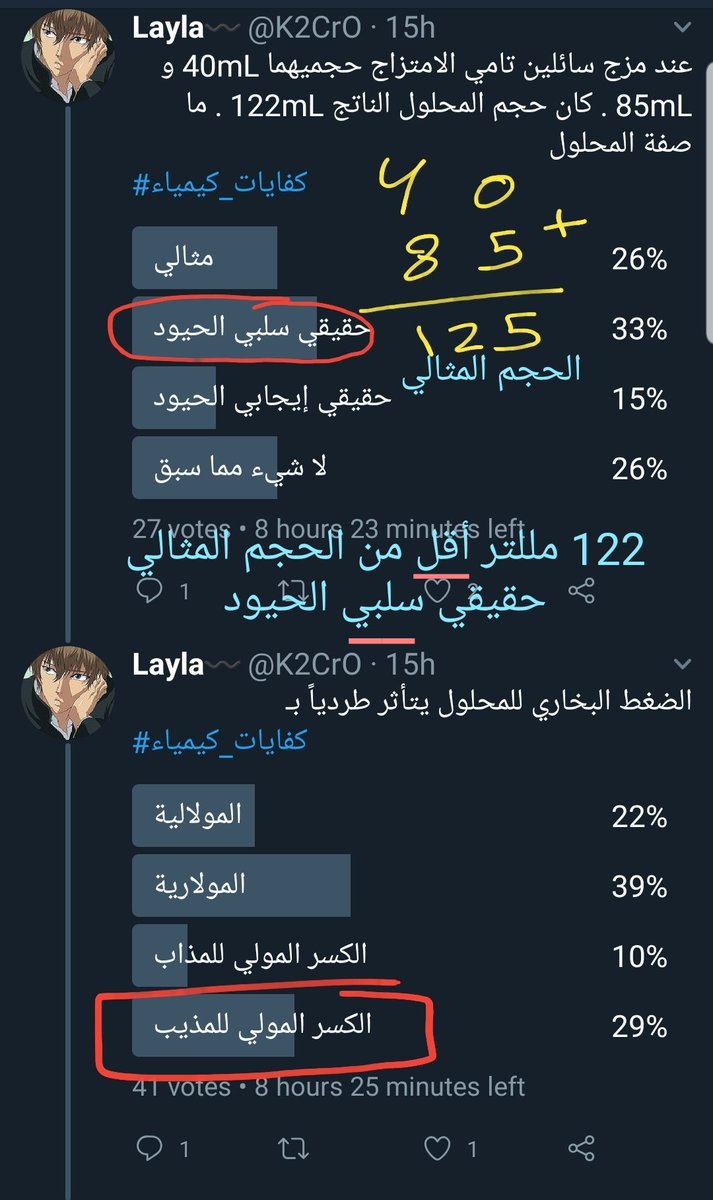
عند مزج سائلين تامي الامتزاج حجميهما 40mL و 85mL . كان حجم المحلول الناتج 122mL . ما صفة المحلول
#كفايات_كيمياء
#كفايات_كيمياء
الضغط البخاري للمحلول يتأثر طردياً بـ
#كفايات_كيمياء
#كفايات_كيمياء
الضغط الأسموزي
انتقال جزيئات المذيب من المحلول المخفف إلى المحلول المركز
#كفايات_كيمياء
كلما كان المحلول أكثر تركيزاً يحتاج المذيب لضغط اضافي لكي ينتقل عبر الغشاء
القانون يشبه قانون الغاز المثالي إلا أن ضغط الغاز رمزه P والضغط الأسموزي Π
Π = inRT/V = iMRT
انتقال جزيئات المذيب من المحلول المخفف إلى المحلول المركز
#كفايات_كيمياء
كلما كان المحلول أكثر تركيزاً يحتاج المذيب لضغط اضافي لكي ينتقل عبر الغشاء
القانون يشبه قانون الغاز المثالي إلا أن ضغط الغاز رمزه P والضغط الأسموزي Π
Π = inRT/V = iMRT
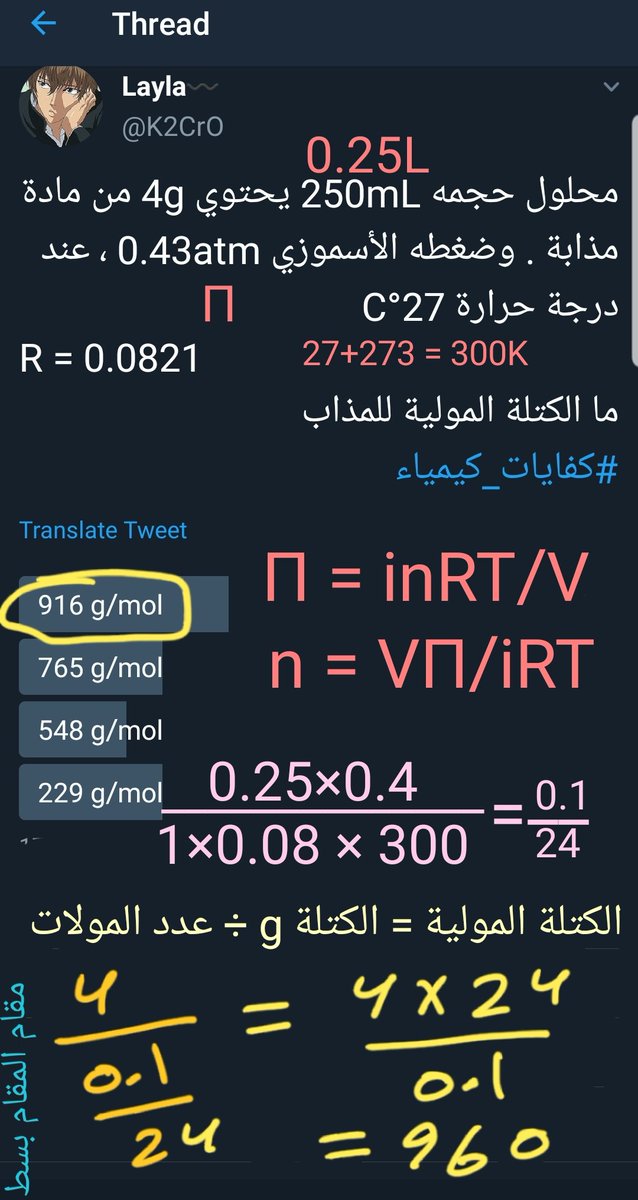
محلول حجمه 250mL يحتوي 4g من مادة مذابة . وضغطه الأسموزي 0.43atm ، عند درجة حرارة 27°C
R = 0.0821
ما الكتلة المولية للمذاب
#كفايات_كيمياء
R = 0.0821
ما الكتلة المولية للمذاب
#كفايات_كيمياء
من المفيد اشتقاق القوانين اذا فيه مجهول ورا مجهول
مثال، بدل ما احسب عدد المولات بقانون الضغط الأسموزي ثم احسب الكتلة المولية بعدد المولات و الكتلة
نكتب القوانين التي نحتاجها ونركبها على بعض لنحصل على قانون واحد كل متغيراته معطى ما عدا المطلوب
#كفايات_كيمياء
مثال، بدل ما احسب عدد المولات بقانون الضغط الأسموزي ثم احسب الكتلة المولية بعدد المولات و الكتلة
نكتب القوانين التي نحتاجها ونركبها على بعض لنحصل على قانون واحد كل متغيراته معطى ما عدا المطلوب
#كفايات_كيمياء
الانخفاض في درجة الغليان والارتفاع في درجة التجمد يتأثران طردياً بالمولالية الفعلية للمحلول
المولالية الفعلية = المولال × عدد الأيونات
i × m
قانون الارتفاع والانخفاض
△T = i×m×K
درجة غليان المحلول=
درجة غليان المذيب + △T
درجة تجمد المحلول =
درجة تجمد المذيب + △T
المولالية الفعلية = المولال × عدد الأيونات
i × m
قانون الارتفاع والانخفاض
△T = i×m×K
درجة غليان المحلول=
درجة غليان المذيب + △T
درجة تجمد المحلول =
درجة تجمد المذيب + △T
درجة تجمد محلول حضر بإذابة 82 g من جليكول الإيثيلين C2H4(OH)2 في 500 g من الماء . علما بأن ثابت انخفاض درجة التجمد 1.86 ºC/m
C = 12 , H = 1 , O = 16
#كفايات_كيمياء
C = 12 , H = 1 , O = 16
#كفايات_كيمياء
مثال
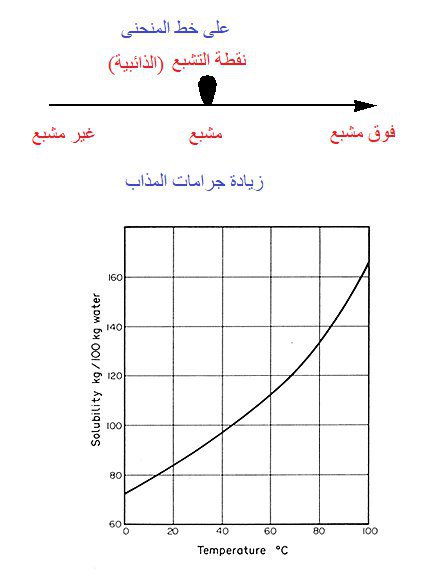
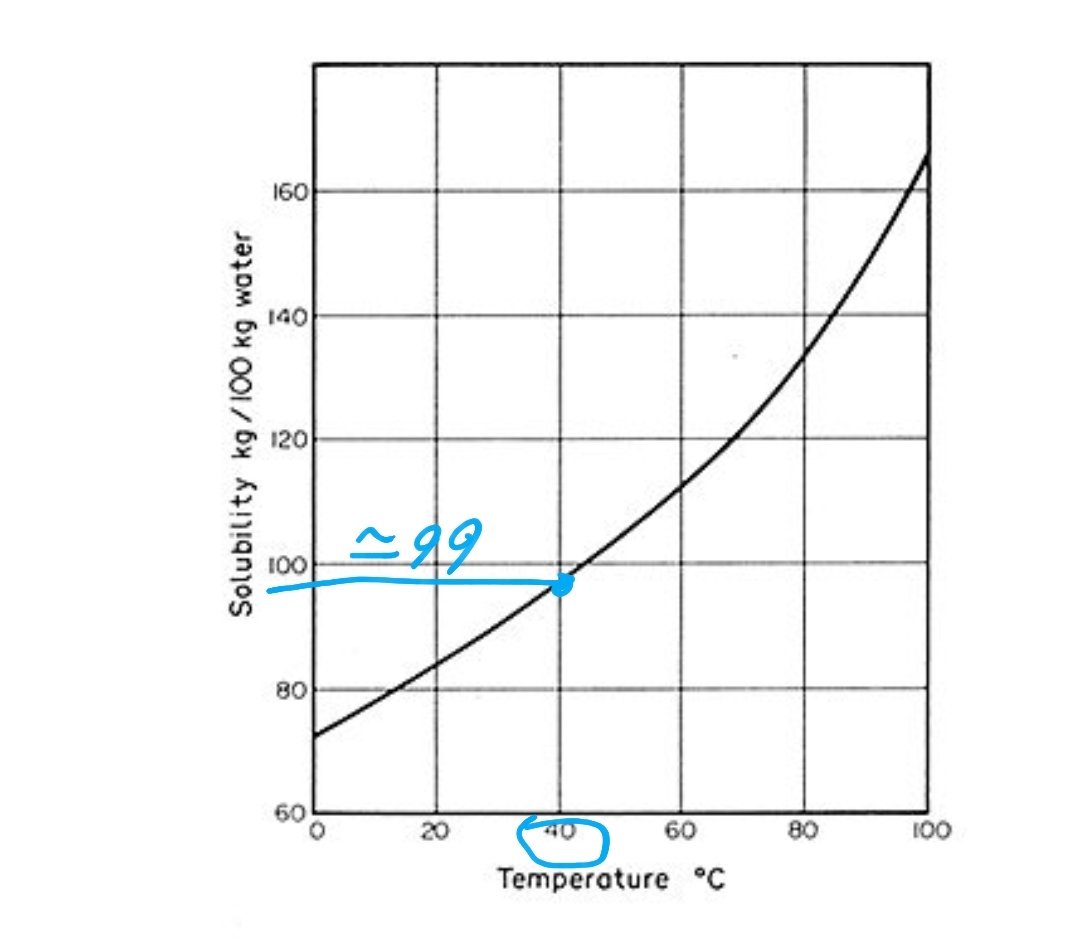
عند درجة حرارة 40°C نقطة تشبع المادة التي لها منحنى الذائبية 👇 هي تقريبا 99g
لو 100g ماء درجة حرارته 40°C اذيب فيه 50g فهو غير مشبع لأنه أقل من نقطة التشبع
لو أذيب فيه 110g فهو فوق مشبع لأنه تجاوز نقطة التشبع
لو أذيب فيه 99g فالمحلول مشبع
#كفايات_كيمياء
عند درجة حرارة 40°C نقطة تشبع المادة التي لها منحنى الذائبية 👇 هي تقريبا 99g
لو 100g ماء درجة حرارته 40°C اذيب فيه 50g فهو غير مشبع لأنه أقل من نقطة التشبع
لو أذيب فيه 110g فهو فوق مشبع لأنه تجاوز نقطة التشبع
لو أذيب فيه 99g فالمحلول مشبع
#كفايات_كيمياء
الضغط البخاري للماء عند 25℃ هو 22.8 mmHg, كم الضغط البخاري لمحلول مكون من3mol مذاب غير متطاير و 12mol ماء #كفايات_كيمياء
أذيب مولين من كلوريد الصوديوم في 1Kg من مذيب مجهول. فارتفعت درجة الغليان بمقدار 6K . ما ثابت غليان المذيب
جاري تحميل الاقتراحات...